专为高中生提供有价值的资讯
双线桥法是表示氧化还原反应中同一元素得失电子的方法。此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。

标变价
明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线
将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失
1.标电子转移或偏离数
明确标出得失电子数,格式为“得/失 发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化
一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型
一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒
检查得失电子数是否相等,如不相等则重新分析。
用双线桥法标出电子转移的方向和数目,并指出反应的氧化剂与还原剂
Zn+H2SO4═ZnSO4+H2↑______
氧化剂:______还原剂:______.
正确答案
解:在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,

答案解析
解:在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
该反应中转移的电子数为2e-,电子转移的方向和数目为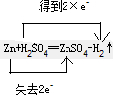 ,故答案为:
,故答案为: ;H2SO4;Zn.
;H2SO4;Zn.
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告