专为高中生提供有价值的资讯
氧化性是指物质得电子的能力。处于高价态的物质和活泼非金属单质(如:氟、氯、氧等)一般具有氧化性,而处于低价态的物质一般具有还原性。
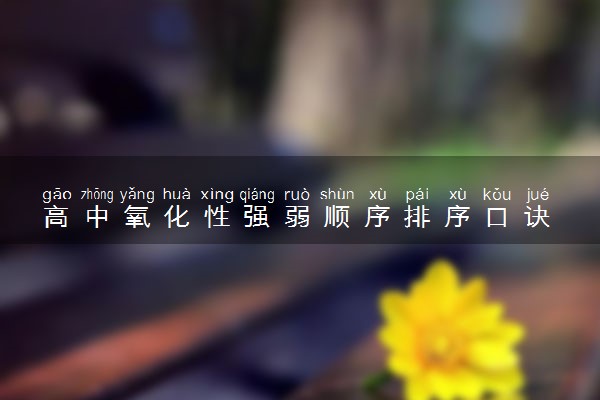
常见离子还原性:S2->SO3(2-)>I->Fe2+>Br->Cl->F-
常见离子氧化性:K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe2+<Pb2+<H+<Cu2+<Fe3+<Ag+
氧化还原反应是在反应前后元素的氧化数具有相应的升降变化的化学反应。在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。此类反应都遵守电荷守恒。在氧化还原反应里,氧化与还原必然以等量同时进行。两者可以比喻为阴阳之间相互依靠、转化、消长且互相对立的关系。有机化学中也存在氧化还原反应。
氧化还原反应中,存在以下一般规律:
强弱律:氧化性中,氧化剂>氧化产物;还原性中,还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。
守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
1、根据化学方程式判断
氧化剂(氧化性)+还原剂(还原性)→还原产物+氧化产物
氧化剂----→发生还原反应----→还原产物
还原反应:得电子,化合价降低,被还原
还原剂----→发生氧化反应----→氧化产物
氧化反应:失电子,化合价升高,被氧化
氧化性(得到电子的能力):氧化剂>氧化产物
还原性(失去电子的能力):还原剂>还原产物
这条规则对于任何环境下的任何ΔG<0的反应(即在该环境下可自发进行的反应)都成立,没有任何例外的情况。
不可根据同一个反应中的氧化剂,还原剂判断
自发进行的反应中氧化剂的氧化性可以弱于甚至是远弱于还原剂(中学认为氧化剂氧化性一定强于还原剂,然而这种认知实际上完全错误,氧化剂氧化性与还原剂的氧化性无任何关系)
例如:
过氧化氢的氧化性远强于氯气,且其将氯气氧化为高氯酸是可以自发进行的(标准电极电势差超过0.2,氧化还原反应就可以完全进行):
(标准电极电势:H2O2—1.77—H2O,Cl2—1.36—Cl-,ClO4-—1.39—Cl2)
然而二者的反应却是前者被氧化:H2O2+Cl2→2HCl+O2
这是因为热力学可行的氧化还原反应大都存在动力学障碍
2、根据物质活动性顺序比较
(1)对于金属还原剂来说,金属阳离子的氧化性强弱一般与金属活动性顺序相反,即越位于后面的金属,越容易得电子,氧化性越强。
(2)金属阳离子氧化性的顺序(25℃,pH=1的水溶液中)
Li+<Cs+<Rb+<K+<Ca2+<Na+<Mg2+<Al3+<Mn2+<Zn2+<Cr3+<Fe2+<Ni2+<Sn2+<Pb2+<(H)<Cu2+<Fe3+<Hg22+<Ag+<Hg2+<Pt2+<Au3+(注意Sn2+、Pb2+,不是Sn4+、Pb4+)(Hg对应的是Hg22+而非Hg2+)
(3)金属单质的还原性与氧化性自然完全相反,对应的顺序为:K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
(4)非金属活动性顺序(25℃,pH=14的水溶液中)
F2>Cl2>O3>Br2>I2>O2>S8>C>Si>N2>P>H2
单质氧化性逐渐减弱,对应阴离子还原性增强(注意元素非金属性与单质的氧化性无必然联系,以上顺序为单质氧化性排列)
3、根据反应条件判断
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的难易来判断。反应越容易,该氧化剂氧化性就强。
如:16HCl(浓)+2KMnO4==2KCl+2MnCl2+8H2O+5Cl2(气)
4HCl(浓)+MnO2=加热=MnCl2+2H2O+Cl2(气)
4HCl(g)+O2=加热,CuCl2催化剂=2H2O+2Cl2(气)
氧化性:KMnO4>MnO2>O2
但也不一定正确,因为氧化性更强的物质可能因为动力学障碍导致反应反而更困难,也有可能是反应可逆程度较大导致平衡向ΔG>0的方向移动
4、根据氧化产物的价态高低来判断
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱,如:
2Fe+3Cl2—(点燃)→2FeCl3
Fe+S—(加热)→FeS
氧化性:Cl2>S
但也不一定正确,例如:F2只能将Os氧化到+6价,O2则能氧化到+8价
5、根据元素周期表判断
(1)同主族元素(从上到下)
非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强。
金属原子还原性逐渐增强,对应阳离子氧化性逐渐减弱
(2)同周期主族元素(从左到右)
单质还原性逐渐减弱,氧化性逐渐增强
阳离子氧化性逐渐增强,阴离子还原性逐渐减弱。
6、同周期的主族元素最高价氧化物的水化物(只能从左到右,不可上下或斜向比较)
酸性越强,对应元素氧化性越强
碱性越强,对应元素还原性越强
7、根据原电池的电极反应判断
两种不同的金属构成的原电池的两极。负极金属是电子流出的极,正极金属是电子流入的极。
其还原性:负极金属>正极金属
8、根据物质的浓度大小判断
具有氧化性(或还原性)的物质浓度越大,其氧化性(或还原性)越强,反之则越弱。
9、根据元素化合价价态高低判断
一般来说,变价元素位于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时,既有氧化性又有还原性。一般处于最高价态时,氧化性最强,随着化合价降低,氧化性减弱还原性增强。但也存在反例,例如:酸性水溶液中,0到最高价,氯硫磷氧化性随化合价下降反而而增强
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告