专为高中生提供有价值的资讯
 2023四川省叙州区第二中学高二第二学月考试
2023四川省叙州区第二中学高二第二学月考试
化学试题
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
6.考试时间:150分钟;物理化学生物同堂分卷考试,物理110分,化学100分,生物分90分,共300分
7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64
第I卷 选择题(42分)
1、选择题(每小题6分,共7个小题,共42分;其中每题都为单选题。
1.暖宝宝贴有散热均衡、发热持久、直接撕开外包装便可发热等优点,它能保持51~60℃约12个小时,它采用铁的“氧化放热”原理,利用微孔透氧的技术,采用完全隔绝空气的方式,使其发生原电池反应,铁粉在原电池中

原材料名:铁粉、水、活性炭、蛭石、食盐
A.作正极 B.得到电子 C.被还原 D.作负极
2.下列各种情况下,溶液中离子可能大量共存的是
A.透明澄清溶液中:Cl,Na,Fe,SO
B.水电离的H浓度c(H)=10mol/L的溶液中:Cl,CO,NH,SO
C.使pH=1溶液中:K,Fe,NO,Cl
D.含有HCO的溶液中:NH,K,Na,AlO,SO
3.下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.在含有BaSO沉淀的溶液中加入NaSO固体,c(Ba)增大
D.物质的溶解度都随温度的升高而增加,物质的溶解都是吸热的
4.下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A.凡是中心原子采取sp杂化的分子,其分子构型都是平面三角形
B.对于主族元素,中心原子的杂化轨道数等于价层电子对数
C.杂化轨道可用于形成 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D.Sp杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp杂化轨道
5.下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A.d>a>b>c B.b>c>d>a C.a>b>c>d D.a>b>d>c
6.某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,下列说法正确的是

A.盐桥中通常装有含琼脂的KCl饱和溶液,起作用是平衡电荷,电池工作时,K、Cl会分别进入两边的溶液中
B.该装置工作一段时间后,电极III上有红色固体析出
C.该装置工作一段时间后,③号烧杯中电解质溶液浓度不变,两个电极的质量不变
D.该装置工作时,③号烧杯中的SO向电极IV移动
7.汽车尾气中NO产生的反应为:N(g)+O(g)⇌2NO(g),一定条件下,等物质的量的N(g)和O(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N的浓度随时间的变化.下列叙述正确的是

A.温度T下,该反应的平衡常数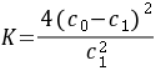 B.温度T下,随着反应的进行,混合气体的密度减小
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
第II卷 非选择题(58分)
8.(14分)光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)已知Se在周期表的位置为 ,硅的基态原子电子排布式为 ,基态Ga原子核外电子占据的最高能级为 ,铜的基态原子价电子排布图为 。
(2)P、S、Ga电负性从大到小的顺序为 。
(3)与Al元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(HBO)在水溶液中能与水反应生成[B(OH)]而体现一元弱酸的性质,[B(OH)]的结构式为 (标出配位键)
(4)已知[Cu(HO)]具有对称的空间构型,[Cu(HO)]中的2个HO被Cl-取代,能得到2种不同结构的产物,则[Cu(HO)]的空间构型为 。
(5)As元素的第一电离能 Se元素的第一电离能(填“大于”、“小于”或“等于”),原因是 。
(6)太阳电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是 。
9.(15分)氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N(g)、H(g)与NH(g)之间转化的能量关系图,则:
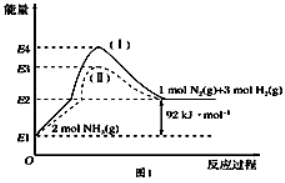
①N(g)与H(g)反应生成NH(g)的热化学方程式为 .
②过程(Ⅰ)和过程(Ⅱ)的反应热 (填 “相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN和3 mol H进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为 .
b.N的平衡转化率为 .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN和0.5 mol NH,则平衡 (填“正向”“逆向”或“不”)移动.
(2)用NH可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH(g)+3O(g) 2N(g)+6HO(g) ΔH=a kJ·mol平衡常数为K
2N(g)+6HO(g) ΔH=a kJ·mol平衡常数为K
反应Ⅱ:N(g)+O(g) 2NO(g) ΔH=b kJ·mol平衡常数为K
2NO(g) ΔH=b kJ·mol平衡常数为K
反应Ⅲ:4NH(g)+6NO(g) 5N(g)+6HO(g) ΔH=c kJ·mol平衡常数为K
5N(g)+6HO(g) ΔH=c kJ·mol平衡常数为K
则反应Ⅱ中的b= (用含a、c的代数式表示),K= (用K和K表示).反应Ⅲ中的ΔS (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH的转化率(α)与压强p的关系如图所示:
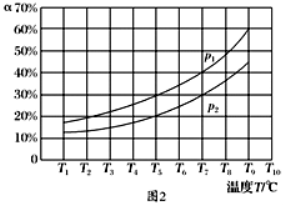
①分析得p p.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是 (填序号).
a.N的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
10.(14分)草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为CoO,含少量FeO、A1O、MnO、MgO、CaO、SiO等)制取CoCO•2HO工艺流程如下

已知:①浸出液含有的阳离子主要有H、Co、Fe、Mn、Ca、Mg、Al等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH) | Al(OH) | Co(OH) | Fe(OH) | Mn(OH) |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)CoO中Co的化合价是
(2)写出浸出过程中NaSO与CoO发生反应的离子方程式:
(3)浸出液中加入NaClO的目的是
(4)加NaCO能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)外,还有的成分是 ,(填化学式)试用离子方程式和必要的文字简述其原理:
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是 ;其使用的适宜pH范围是 .
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(6)滤液I“除钙、镁”是将其转化为MgF、CaF沉淀.已知Ksp(MgF)=7.35×10、Ksp(CaF)=1.05×10,当加入过量NaF后,所得滤液c(Mg)/c(Ca)= .
(7)用mkg水钴矿(含CoO60%)制备CoCO•2HO,最终得到产品mkg,产率为 。(不要求得出计算结果,只需列出数字计算式)。
11.(15分)有机物A可用作果实催熟剂。某同学欲以A为主要原料合成乙酸乙酯,其合成路线如下图所示。请回答:

(1)C分子中官能团的电子式是 ;C的同分异构体F的核磁共振氢谱中,只有一种类型氢原子的吸收峰,F的结构简式是 。
(2)反应②的化学方程式是 ;反应⑤的化学方程式是 ;
(3)为了检验B中的溴元素,以下操作合理的顺序是 (填序号)。
a.加AgNO溶液 b.加NaOH 溶液 c.加热 d.加稀硝酸至溶液显酸性
(4)实验室制A的化学方程式: ;在制备中产生SO会干扰A性质验证,写出SO与溴水反应的离子方程式: 。
2020年春四川省叙州区第二中学高二第二学月考试
化学试题参考答案
1.D 2.A 3.B 4.B 5.A 6.A 7.A
8.第四周期VIA族 1s2s2p3s3p或者[Ne]3s3p4p 3d4sS>P>Ga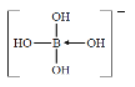 平面四边形 大于 略 略
平面四边形 大于 略 略
9.N(g)+3H(g) 2NH(g) ΔH=-92 kJ·mol相同 K=c(NH)/[c(N)c(H)] 25% 不 (a-c)/3
2NH(g) ΔH=-92 kJ·mol相同 K=c(NH)/[c(N)c(H)] 25% 不 (a-c)/3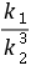 > < bd
> < bd
10.+3 SO+ CoO+4H=2Co+SO+2HO 将浸出液中的Fe氧化成FeFe(OH)Fe+3HO⇌ Fe(OH)+3H,加入的碳酸钠(或CO)与H反应,c(H)降低,从而促进水解平衡向右移动 除去溶液中的MnB 0.7 366×0.6m166 m(1.32mm)
11.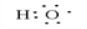 CHOCHCHCHBr + NaOH
CHOCHCHCHBr + NaOH CHCHOH + NaBr CHCOOH+CHOH
CHCHOH + NaBr CHCOOH+CHOH CHCOOCH+HO b c d a CHOH
CHCOOCH+HO b c d a CHOH CH= CH↑+HO Br+ SO+ 2HO =4H+SO
CH= CH↑+HO Br+ SO+ 2HO =4H+SO + 2Br
+ 2Br
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告