专为高中生提供有价值的资讯
放热反应。氮气与氢气的反应是工业制氨气的重要方法,高二的化学会学到。方程式为:N2(g)+3H2(g)=(催化剂,加热加压)2NH3(g);ΔH=-92.4kJ/mol,催化剂是铁触媒,该反应为可逆反应。

N₂(g)+3H₂(g)→2NH₃(g) △H=-92.4kJ/mol,由此可知是放热反应。(在热化学方程式中,若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”)
氨合成将纯净的氢、氮混合气压缩到高压,在催化剂的作用下合成氨。氨合成反应在较高压力和催化剂存在的条件下进行,由于反应后气体中氨含量不高,一般只有100故采用未反应氢氮气循环的流程。
(注意反应发生的条件)
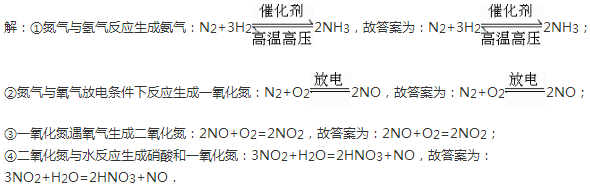
①氮气与氢气:______;
②氮气与氧气:______;
③NO和O2:______;
④NO2和水:______.
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告