专为高中生提供有价值的资讯
不加热。化学反应方程式:Cu+4HNO3(浓)==Cu(NO3)2+2H2O+2NO2↑。离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。浓硝酸具有强氧化性,能和较不活泼金属铜反应生成硝酸铜、二氧化氮和水。下面是具体例题,供参考。
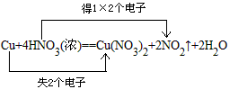
1.浓硝酸和铜反应的化学方程式如下:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(1)指出该氧化还原反应的氧化剂和还原剂,并标出电子转移的方向和数目(在上面方程式中标出)。
(2)若生成标准状况下33.6LNO2气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量。
答案(1)
(2)48g;1.5mol
2.铜与浓硝酸发生反应的化学方程式是____,若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生5.6L气体(标况下),在该反应中,转移电子的物质的量是_____mol,则被还原的硝酸为____mol,起酸性作用的硝酸为___mol,共消耗硝酸____mol。
答案:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;0.4;0.25;0.4;0.65
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告