专为高中生提供有价值的资讯
2021年湖南省普通高中学业水平选择性考试
化 学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:











一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是( )
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
2.下列说法正确的是( )
A.糖类、蛋白质均属于天然有机高分子化合物
B. 粉末在空气中受热,迅速被氧化成Fe3O4
粉末在空气中受热,迅速被氧化成Fe3O4
C. 可漂白纸浆,不可用于杀菌、消毒
可漂白纸浆,不可用于杀菌、消毒
D.镀锌铁皮的镀层破损后,铁皮会加速腐蚀
3.下列实验设计不能达到实验目的的是( )
| 实验目的 | 实验设计 |
A | 检验溶液中 | 取少量待测液,滴加 |
B | 净化实验室制备的 | 气体依次通过盛有饱和 |
C | 测定 | 将待测液滴在湿润的pH试纸上,与标准比色卡对照 |
D | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
4.已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:

下列说法正确的是( )
A.苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
B.环己醇与乙醇互为同系物
C.已二酸与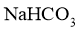 溶液反应有
溶液反应有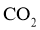 生成
生成
D.环己烷分子中所有碳原子共平面
5. 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A. 含有的中子数为
含有的中子数为
B. 溶液中含有的
溶液中含有的 数为
数为
C. 与
与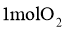 在密闭容器中充分反应后的分子数为
在密闭容器中充分反应后的分子数为
D. 和
和 (均为标准状况)在光照下充分反应后的分子数为
(均为标准状况)在光照下充分反应后的分子数为
6.一种工业制备无水氯化镁的工艺流程如下:

下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融 制备金属镁
制备金属镁
C.“氯化”过程中发生的反应为
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
7.W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2∶1的 分子。下列说法正确的是( )
分子。下列说法正确的是( )
A.简单离子半径:
B.W与Y能形成含有非极性键的化合物
C.X和Y的最简单氢化物的沸点: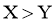
D.由W、X、Y三种元素所组成化合物的水溶液均显酸性
8. 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是( )
。下列说法错误的是( )
A.产生224 L(标准状况) 时,反应中转移
时,反应中转移
B.反应中氧化剂和还原剂的物质的量之比为11∶6
C.可用石灰乳吸收反应产生的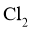 制备漂白粉
制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在
的存在
9.常温下,用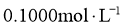 的盐酸分别滴定20.00mL浓度均为
的盐酸分别滴定20.00mL浓度均为 的三种一元弱酸的钠盐
的三种一元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是( )
溶液,滴定曲线如图所示。下列判断错误的是( )

A.该 溶液中:
溶液中:
B.三种一元弱酸的电离常数:
C.当 时,三种溶液中:
时,三种溶液中:
D.分别滴加20.00mL盐酸后,再将三种溶液混合:
10.锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图所示:

下列说法错误的是( )
A.放电时,N极为正极
B.放电时,左侧贮液器中 的浓度不断减小
的浓度不断减小
C.充电时,M极的电极反应式为
D.隔膜允许阳离子通过,也允许阴离子通过
二、选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.已知:
 ,向一恒温恒容的密闭容器中充入
,向一恒温恒容的密闭容器中充入 和
和 发生反应,
发生反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )

A.容器内压强不变,表明反应达到平衡
B. 时改变的条件:向容器中加入C
时改变的条件:向容器中加入C
C.平衡时A的体积分数 :
:
D.平衡常数K: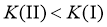
12.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
| 粒子组 | 判断和分析 |
A |
| 不能大量共存,因发生反应: |
B |
| 不能大量共存,因发生反应: |
C |
| 能大量共存,粒子间不反应 |
D |
| 能大量共存,粒子间不反应 |
13.1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:

已知:
下列说法正确的是( )
A.装置I中回流的目的是为了减少物质的挥发,提高产率
B.装置Ⅱ中a为进水口,b为出水口
C.用装置Ⅲ萃取分液时,将分层的液体依次从下口放出
D.经装置Ⅲ得到的粗产品干燥后,使用装置Ⅱ再次蒸馏,可得到更纯的产品
14.铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:

下列说法错误的是( )
A.该过程的总反应为 
B. 浓度过大或者过小,均导致反应速率降低
浓度过大或者过小,均导致反应速率降低
C.该催化循环中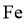 元素的化合价发生了变化
元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
二、非选择题:包括必考题和选考题两部分。第15~17题为必考题,每个试题考生都必须作答。第18、19题为选考题,考生根据要求作答。
(一)必考题:此题包括3小题,共39分。
15.(12分)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
的制备

步骤Ⅱ.产品中 含量测定
含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸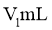 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
④平行测定三次, 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表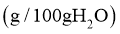
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 11.9 | 15.8 | 21.0 | 27.0 |
|
|
|
| 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
(1)步骤I中晶体A的化学式为__________,晶体A能够析出的原因是__________;
(2)步骤I中“300℃加热”所选用的仪器是__________(填标号);
A. B.
B. C.
C. D.
D.
(3)指示剂N为__________,描述第二滴定终点前后颜色变化__________;
(4)产品中 的质量分数为__________(保留三位有效数字);
的质量分数为__________(保留三位有效数字);
(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则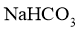 质量分数的计算结果__________(填“偏大”“偏小”或“无影响”)。
质量分数的计算结果__________(填“偏大”“偏小”或“无影响”)。
16.(14分)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I.氨热分解法制氢气
相关化学键的键能数据
化学键 |
|
|
|
键能 | 946 | 436.0 | 390.8 |
在一定温度下,利用催化剂将 分解为
分解为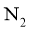 和
和 。回答下列问题:
。回答下列问题:
(1)反应
 _________
_________ ;
;
(2)已知该反应的 ,在下列哪些温度下反应能自发进行?_________(填标号);
,在下列哪些温度下反应能自发进行?_________(填标号);
A.25℃ B.125℃ C.225℃ D.325℃
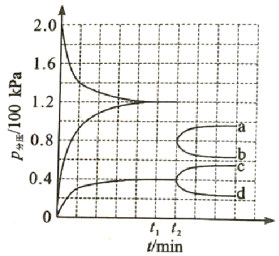
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将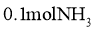 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变, 时反应达到平衡,用
时反应达到平衡,用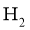 的浓度变化表示
的浓度变化表示 时间内的反应速率
时间内的反应速率 ________
________ (用含
(用含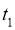 的代数式表示);
的代数式表示);
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是_________(用图中a、b、c、d表示),理由是__________;
分压变化趋势的曲线是_________(用图中a、b、c、d表示),理由是__________;
③在该温度下,反应的标准平衡常数 _________。
_________。
(已知:分压=总压×该组分物质的量分数,对于反应
 ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
方法Ⅱ.氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。

(4)电解过程中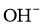 的移动方向为__________(填“从左往右”或“从右往左”);
的移动方向为__________(填“从左往右”或“从右往左”);
(5)阳极的电极反应式为_________。
KOH溶液KOH溶液
17.(13分) 可用于催化剂载体及功能材料的制备。天然独居石中,铈
可用于催化剂载体及功能材料的制备。天然独居石中,铈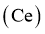 主要以
主要以 形式存在,还含有
形式存在,还含有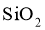 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如下:
的工艺流程如下:

回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为__________;
(2)为提高“水浸”效率,可采取的措施有__________(至少写两条);
(3)滤渣Ⅲ的主要成分是__________(填化学式);
(4)加入絮凝剂的目的是__________;
(5)“沉铈”过程中,生成 的离子方程式为__________,常温下加入的
的离子方程式为__________,常温下加入的 溶液呈__________(填“酸性”“碱性”或“中性”)(已知:
溶液呈__________(填“酸性”“碱性”或“中性”)(已知: 的
的 ,
,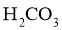 的
的 ,
,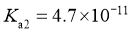 );
);
(6)滤渣Ⅱ的主要成分为 ,在高温条件下,
,在高温条件下, 、葡萄糖
、葡萄糖 和
和 可制备电极材料
可制备电极材料 ,同时生成
,同时生成 和
和 ,该反应的化学方程式为__________。
,该反应的化学方程式为__________。
(二)选考题:共15分。请考生从给出的两道题中任选一题作答。如果多做,则按所做的第一题计分。
18.[选修3:物质结构与性质](15分)
硅、锗 及其化合物广泛应用于光电材料领域。回答下列问题:
及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为_________,晶体硅和碳化硅熔点较高的是__________(填化学式);
(2)硅和卤素单质反应可以得到 。
。
 的熔沸点
的熔沸点
|
|
|
|
|
熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
①0℃时, 、
、 、
、 、
、 呈液态的是________(填化学式),沸点依次升高的原因是_________,气态
呈液态的是________(填化学式),沸点依次升高的原因是_________,气态 分子的空间构型是___________;
分子的空间构型是___________;
② 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:
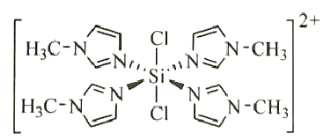
N-甲基咪唑分子中碳原子的杂化轨道类型为__________,H、C、N的电负性由大到小的顺序为__________,1个 中含有__________个
中含有__________个 键;
键;
(3)下图是 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。

①己知化合物中 和
和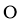 的原子个数比为1∶4,图中Z表示_________原子(填元素符号),该化合物的化学式为_________;
的原子个数比为1∶4,图中Z表示_________原子(填元素符号),该化合物的化学式为_________;
②已知该晶胞的晶胞参数分别为 、
、 、
、 ,
, ,则该晶体的密度
,则该晶体的密度 _________
_________ (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为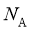 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
19.[选修5:有机化学基础](15分)
叶酸拮抗剂 是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下:
是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下:
回答下列问题:
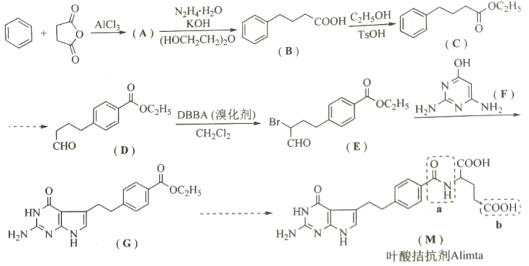
已知:
(1)A的结构简式为__________;
(2) ,
, 的反应类型分别是__________,__________;
的反应类型分别是__________,__________;
(3)M中虚线框内官能团的名称为a__________,b__________;
(4)B有多种同分异构体,同时满足下列条件的同分异构体有__________种(不考虑立体异构);
①苯环上有2个取代基②能够发生银镜反应③与 溶液发生显色发应
溶液发生显色发应
其中核磁共振氢谱有五组峰,且峰面积之比为6∶2∶2∶1∶1的结构简式为__________;
(5)结合上述信息,写出丁二酸酐和乙二醇合成聚丁二酸乙二醇酯的反应方程式__________;
(6)参照上述合成路线,以乙烯和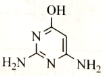 为原料,设计合成
为原料,设计合成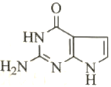 的路线__________(其他试剂任选)。
的路线__________(其他试剂任选)。
Copyright 2019-2029 http://www.laigaokao.com 【来高考】 皖ICP备19022700号-4
声明: 本站 所有软件和文章来自互联网 如有异议 请与本站联系 本站为非赢利性网站 不接受任何赞助和广告